Limpieza suave para piel de recién nacido y sensible.
Seleccionar Región
-
Europe
-
Americas
-
Africa and Middle East
-
Asia Pacific
Arnold Marisa (1), Wisdom Shadrach (1), Kerrie Holohan (1), Abed Alkarem Abu Alhaija (2), Emer Gilligan (3), Jill Sommerville (3), Niall Burke (1) (*) y Tim Yeomans (1)
1 Centro de Biotecnología Aplicada Shannon, Universidad Tecnológica de Munster, V92 CX88 Tralee, Irlanda; [email protected] (WS); [email protected] (TY)
2 División de Biociencia Oral, Hospital Dental de Dublín, Trinity College Dublin, D02 F859 Dublín, Irlanda
3 WaterWipes UC., Polígono Industrial Donore Road, Donore Road, Rathmullan, A92 VX00 Drogheda, Irlanda; [email protected] (EG); [email protected] (JS)
*Correspondencia: [email protected]
Editora académica: María Manconi
Envío recibido: 31 de julio de 2024 / Revisado: 13 de septiembre de 2024 / Aceptado: 26 de septiembre de 2024 / Publicado: 1 de octubre de 2024
Abstracto
Una función clave de las toallitas limpiadoras es su eficacia para eliminar la suciedad y la contaminación microbiana de la piel hasta niveles seguros o indetectables, lo cual se determina tradicionalmente mediante el método gravimétrico, que se ha reportado como propenso a errores experimentales. Este estudio evalúa la eficacia de una toallita limpiadora a base de agua, WaterWipes® (WaterWipes, UC, Drogheda, Irlanda), para eliminar materia fecal sintética (Feclone™, SiliClone Creations LLC, Havertown, PA, Estados Unidos) y Escherichia coli (NCTC 10538) de la piel de voluntarios. La primera se realizó mediante un dispositivo de análisis dérmico llamado cámara Antera 3D™ (Miravex Ltd., Dublín, Irlanda) y la segunda mediante métodos microbiológicos estándar. Se aplicó Feclone™ en los antebrazos de los participantes y la cámara Antera 3D™ capturó imágenes detalladas de la superficie de la piel antes y después de la limpieza. El método de la cámara Antera 3D™ resultó eficaz para medir la eficiencia de la limpieza, ya que la toallita eliminó todos los restos detectables del Feclone™ aplicado. Se observó una reducción promedio del 39,05 %, 34,39 % y 39,98 % en el área total de poros (mm²), el recuento de poros y el volumen total de poros (mm³) en los participantes de la prueba después de la limpieza. La toallita eliminó el 99,99 % de la E. coli (NCTC 10538) aplicada, según se midió mediante el método de recuento microbiano en placa. En conclusión, el método de la cámara Antera 3D™ resultó eficaz para evaluar la eliminación del Feclone™ aplicado tópicamente.
Palabras clave: toallitas limpiadoras; cámara Antera 3D™; Feclone™; WaterWipes®; eliminación de bacterias
1. Introducción
Las toallitas húmedas se pueden describir como agentes de limpieza y generalmente se dividen en toallitas secas y húmedas, con el uso de toallitas húmedas aumentando en los últimos años, especialmente en relación con la higiene de bebés y niños pequeños [ 1 ]. Los estudios muestran que el uso de toallitas húmedas mejora los resultados de la limpieza de los pañales para bebés, ofreciendo una limpieza eficiente y un eritema cutáneo reducido, adecuado tanto para superficies de piel intactas como dañadas en comparación con el uso de agua y tela [ 2 , 3 , 4 , 5 ]. Las toallitas húmedas para bebés generalmente consisten en materiales de lámina base formulados con un surfactante de limpieza suave, conservantes y agentes amortiguadores del pH. El agua se usa generalmente como componente base en toallitas para bebés con el fin de limpiar la piel sensible y los residuos fecales de los bebés [ 4 , 6 ]. Una mesa redonda europea ha recomendado que las toallitas húmedas diseñadas principalmente para uso de bebés no deben tener el potencial de causar reacciones de sensibilidad en la piel y deben formularse con ingredientes que sean seguros para el uso a largo plazo [ 7 ]. Las toallitas húmedas diseñadas para aplicaciones de limpieza y desinfección se someten a pruebas estándar, como pruebas microbiológicas, eficiencia de limpieza, recolección de humedad de la toallita y formulación de loción [ 1 ], y la eficiencia de limpieza se determina tradicionalmente mediante métodos gravimétricos de limpieza (como la técnica de recuperación de chocolate derretido) que, según se ha informado, son propensos a errores experimentales [ 1 , 8 ].
Por lo tanto, este estudio busca diseñar y evaluar un nuevo método no gravimétrico con un posible uso futuro para evaluar la eficiencia de limpieza de productos de toallitas comerciales nuevos y existentes. El método diseñado implica el uso de una cámara Antera 3D™ conocida por sus imágenes dérmicas en tiempo real, con ventajas como la entrega de datos precisos, rápidos y objetivos en diferentes áreas de estudios de la piel y evaluación de productos cosméticos [ 9 , 10 , 11 , 12 ]. La cámara Antera 3D™ (Miravex Ltd., Dublín, Irlanda), bajo la patente europea n.º 2400890, funciona según el principio de iluminación de la piel desde múltiples ángulos, con datos de la superficie de la piel reproducidos en 3D utilizando un software habilitado por computadora para interpretar la luz reflejada de la superficie de la piel. Los datos relevantes de la piel que se pueden generar con este instrumento incluyen recuentos de poros de la piel, arrugas, rugosidad y análisis de pigmentación [ 13 ]. Los poros de la piel contribuyen a la liberación de sebo, sudor y residuos celulares. Se ha informado que el tratamiento de los poros faciales dilatados (con terapias como ultrasonido, luz de banda ancha, radiofrecuencia y láseres fraccionados no ablativos) es una de las principales demandas cosméticas [ 14 ].
El método diseñado se evaluó utilizando WaterWipes® (WaterWipes UC, Drogheda, Irlanda), una marca comercial de toallitas húmedas sin surfactantes elaboradas con ingredientes mínimos. Su composición básica comprende materiales fibrosos sin plástico (láminas humedecidas de tela de encaje hilado no tejido 100% viscosa). Las láminas se humedecen con agua ultrapurificada (99.9%) y extracto de semilla de citrus grandis (pomelo) al 0.1% [ 15 ]. Su eficiencia de limpieza se probó contra aplicaciones tópicas de FecloneTM y E. coli en dos ensayos separados con voluntarios humanos. FecloneTM (SiliClone Creations LLC, Havertown, PA, Estados Unidos) es una marca registrada de material fecal artificial simulado con aplicaciones reportadas en la prueba de productos alimenticios, así como en toallitas para la incontinencia y para bebés [ 16 , 17 ]. Se utilizó el método de cámara Antera 3DTM adaptado para evaluar la eficacia de limpieza de un producto de limpieza específico disponible comercialmente en el ensayo FecloneTM y el método de conteo de placas para el ensayo de E. coli.
2. Materiales y métodos
2.1. Evaluación de la eficacia de limpieza del producto Wipe para eliminar Feclone™
Este estudio se realizó con base en la aprobación ética del Comité de Ética de Investigación Humana de la Universidad Tecnológica de Munster (HREC-FER-24-004) y se operó de acuerdo con BS EN 1500:2013 [ 1 ]. Los criterios de inclusión para el estudio fueron hombres y mujeres mayores de 18 años con piel humana adulta sana, intacta y no sensible, mientras que los criterios de exclusión fueron adultos vulnerables, afecciones cutáneas, sensibilidad cutánea (autoinformada) o piel rota en el antebrazo. El panel resultante consistió en 25 voluntarios humanos (18 mujeres y 7 hombres); las muestras e imágenes tomadas fueron anonimizadas para los participantes. El rango de edad de los participantes en este estudio fue de 18 a 50 años. La investigación se realizó en un entorno controlado en el Laboratorio del Centro de Biotecnología Aplicada de Shannon (MTU, Kerry, Irlanda) con temperatura ambiente (25 ± 2 °C) y humedad relativa (50 ± 5%).
2.1.1. Preparación de Feclone™
En total, se calentaron 120 ml de agua destilada a 99 °C en un recipiente tapado; simultáneamente, se precalentaron 40 g de Feclone™ durante 5 min con una placa calefactora. Al alcanzar la temperatura deseada, se añadió cuidadosamente el agua caliente al Feclone™ (SiliClone Creations LLC, Havertown, PA, EE. UU.), y se agitó vigorosamente durante aproximadamente 20 s con una espátula. A continuación, se cubrió la mezcla con papel de aluminio y se incubó a 99 °C durante un mínimo de 30 min, removiendo suavemente después de los primeros 10 min. Al finalizar la incubación, se realizó una breve agitación final antes de alicuotar la solución caliente en tubos de 50 ml. Los tubos se mantuvieron a 4 °C hasta su uso.
2.1.2. Aplicación de Feclone™ en el antebrazo humano
Los voluntarios se sentaron con un brazo apoyado en una mesa y con el antebrazo expuesto, dejándolos aclimatarse a las condiciones de la sala durante 3 minutos. El propósito de este estudio fue determinar la eficacia de limpieza de la toallita, por lo que la temperatura de la piel se consideró una prioridad menor. Dentro de una sección de 8 × 8 cm, se aseguró un área de 4 × 4 cm colocando una plantilla en el antebrazo del voluntario. Se aplicó una cantidad de 2 g de Feclone™ al área de 4 × 4 cm y se extendió uniformemente con una espátula. El procedimiento de limpieza consistió en limpiar el área contaminada vertical y horizontalmente de la siguiente manera: de izquierda a derecha con una superficie de la toallita, seguido de derecha a izquierda con otra superficie de la toallita, luego de arriba a abajo con una superficie de la toallita nueva y, finalmente, de abajo a arriba con una superficie de la toallita nueva, todo de la misma hoja.
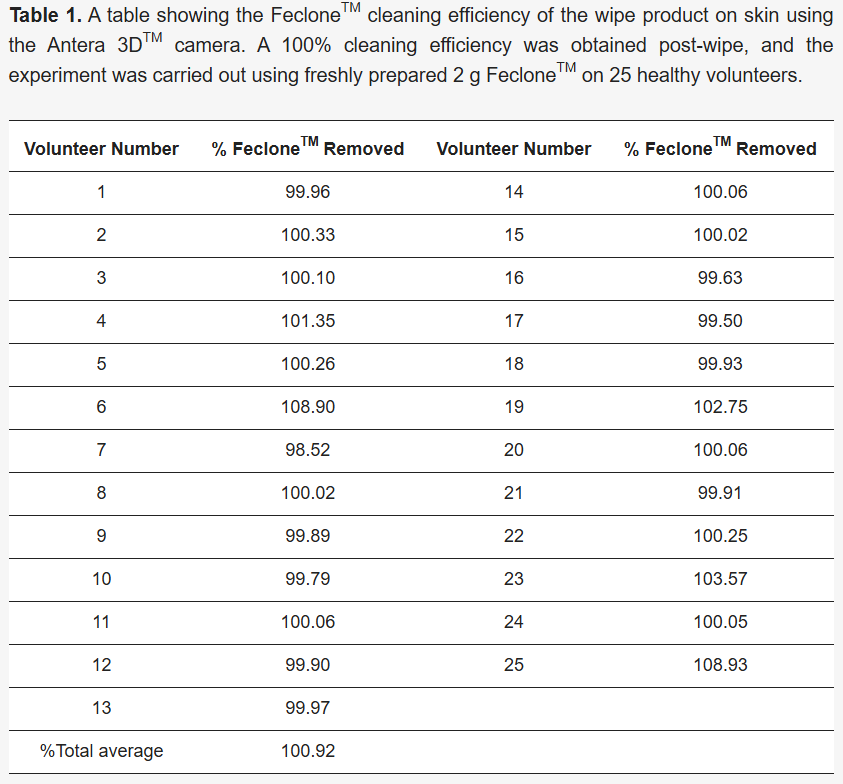
Se capturó una imagen del área marcada con una cámara Antera 3D™ antes y después de la limpieza, así como directamente después de la aplicación de Feclone™, y se analizó con el software Antera 3D™ (versión 3.1.8) para comparar las condiciones previas y posteriores a la limpieza. El porcentaje de eliminación se calculó utilizando el parámetro de volumen del software, que mide la depresión y la elevación sobre una superficie de referencia normalizada. El volumen de la piel (mm3) posterior a la limpieza se restó del volumen de la piel previo a la aplicación de FecloneTM; el valor obtenido se restó del volumen de la piel (mm3) con la limpieza previa con Feclone™ y se dividió entre el volumen de la piel (mm3) con la limpieza previa con Feclone™. Este valor se multiplicó por 100 para calcular el porcentaje de eliminación (fórmula en la Sección 3.1 ) con el resultado obtenido que se encuentra en la Sección 3.1 ( Tabla 1 ).
2.2. Evaluación del impacto del producto de toallita en los poros de la piel humana
Este estudio se realizó en el antebrazo desnudo de cada voluntario (25 en total). La zona de prueba se delimitó en el brazo como se describió previamente, de modo que las fotos del antes y el después fueran exactamente de la misma zona. A continuación, se fotografió la zona y se aplicaron 2 g de Feclone™. El procedimiento de limpieza posterior se realizó como se describe en la Sección 2.1.2 y los resultados obtenidos se pueden consultar en la Sección 3.2 ( Tabla 2 ). La fórmula utilizada para los diferentes parámetros de poros del software Antera 3D™ (versión 3.1.8) incluye:
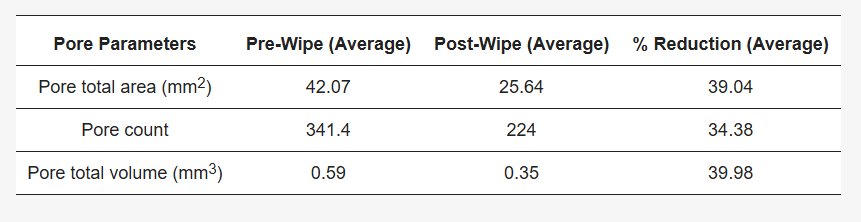
Tabla 2. Tabla que muestra el impacto de la toallita de prueba en los poros de la piel. Los datos se obtuvieron y analizaron mediante el método de la cámara Antera 3D™. Se observó una reducción significativa en el recuento, volumen y área promedio de poros después de la toallita, en comparación con las imágenes de la misma superficie cutánea obtenidas antes de la toallita.
- Volumen total de poros (mm3) V = suma de la profundidad de cada píxel * área del píxel.
- Área total de poros (mm2) = número de píxeles deprimidos * área de píxeles.
- Recuento de poros = islas de depresión aisladas dentro de la región de interés seleccionada.
2.3. Evaluación de la eficacia de limpieza del producto Wipe contra E. coli (NCTC 10538)
Este estudio se realizó con KWIK STIK E. coli (NCTC 10538), medios de cultivo bacterianos y 25 voluntarios humanos. Los medios de cultivo y los cultivos iniciadores bacterianos se prepararon antes de la prueba en voluntarios.
2.3.1. Cultivo bacteriano
Se añadieron 30 g de caldo triptona soja (TSB) en polvo a 100 ml de agua destilada. La mezcla se agitó vigorosamente hasta su completa disolución. A continuación, se ajustó el volumen con agua destilada hasta alcanzar un volumen final de 1 l. Posteriormente, el medio se esterilizó en autoclave. El medio de agar triptona soja (TSA) se preparó de forma similar, pero utilizando 40 g/l de TSA en polvo.
Las células de Escherichia coli (E. coli) (NCTC 10538) se inocularon inicialmente en placas de TSA y se colocaron en una incubadora a 37 °C durante la noche. Al día siguiente, se seleccionó una colonia y se transfirió a otra placa de TSA, que se incubó en las mismas condiciones. Al día siguiente, se seleccionó una colonia y se introdujo en 10 ml de medio TSB. Este cultivo se incubó durante la noche a temperatura ambiente con agitación. Al día siguiente, se midió la densidad óptica (DO) del cultivo con un espectrofotómetro y las células se diluyeron con medio TSB hasta alcanzar una DO de 0,15.
2.3.2. Aplicación de bacterias en el antebrazo de voluntarios
Este método se basó en las directrices descritas en BS EN 1500:2013 [ 1 ]. Los cultivos de caldo de E. coli con una densidad óptica (DO) de 0,15 se usaron sistemáticamente durante todo el experimento; el número promedio de E. coli utilizado fue de 1,55 × 108 UFC/ml. Una alícuota de este cultivo se usó para la enumeración utilizando el método de recuento en placa. Los voluntarios se limpiaron las manos y los brazos con un jabón no antibacteriano, seguido de un hisopado del área limpia, que se colocó en 1 ml de medio salino tamponado con fosfato (PBS) para la enumeración a través del método de recuento en placa (sirviendo como control). Se marcó un área de 4 × 4 cm en la piel del voluntario para la prueba. Posteriormente, se pipetearon 100 µL de cultivo nocturno a una DO de 0,15 sobre el área de prueba, se extendieron suavemente utilizando un esparcidor en forma de L y se dejaron secar al aire durante 3 min.
Esto fue seguido por el procedimiento de limpieza utilizando el producto de toallita como se describe en la Sección 2.1.2 . La toallita usada fue entonces sumergida en 10 mL de medio neutralizante Dey-Engley (D3435, Merck, Darmstadt, Alemania), agitada en vórtex por 60 s, y diluida serialmente dos veces con medio PBS. Subsecuentemente, 0.1 mL de las bacterias fueron aplicadas a una placa de agar para cultivo durante la noche y cuantificación subsiguiente. Después del proceso de limpieza, la superficie del área de prueba del antebrazo fue frotada con un hisopo humedecido. El hisopo fue entonces colocado en 1 mL de medio PBS, y 0.1 mL fueron aplicados a una placa de agar para cuantificación. Diluciones seriales de puro, 10−1, y 10−2 fueron aplicadas a una placa de agar para cuantificación por triplicado. El stock original de bacterias se diluyó en serie a 10−3, 10−4 y 10−5 y se sembró en placas de agar para el recuento de colonias. Para cada área, se calculó la UFC/ml mediante la siguiente fórmula:
UFC/mL=(N ∗ DF)/VUFC/mL=(N ∗ DF)/VC
donde UFC/mL = Unidad formadora de colonias por mL:
N = Número de colonias (número total de colonias contadas en las placas dentro del rango óptimo).
DF = Factor de dilución (el recíproco de la dilución utilizada para el enchapado).
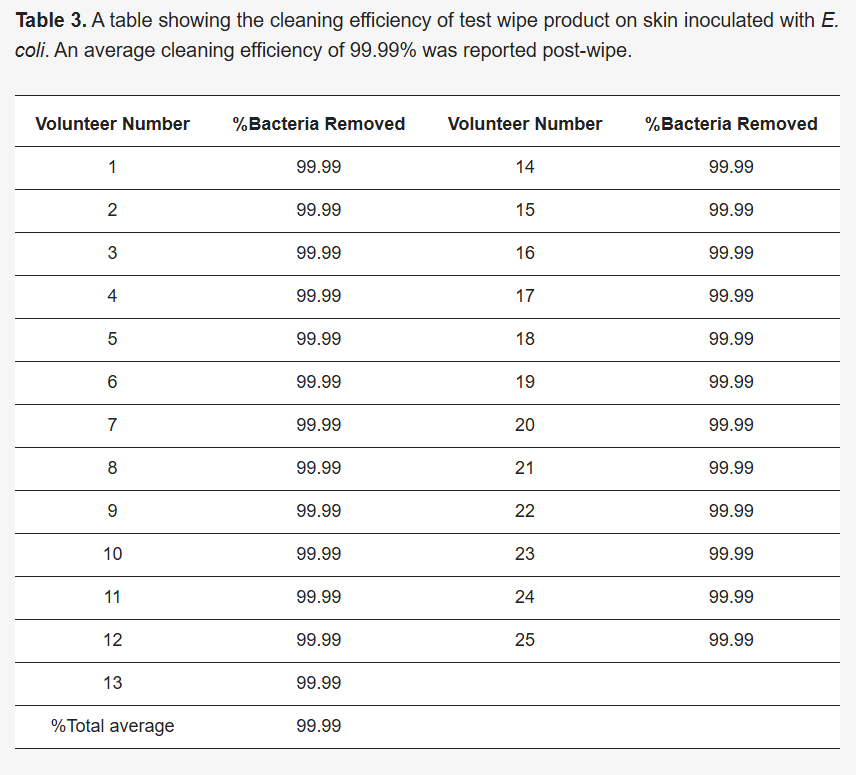
VC = Volumen de cultivo sembrado (el volumen del cultivo diluido sembrado en la placa de agar). La tabla que muestra el porcentaje de bacterias eliminadas se encuentra en la Sección 3.3 ( Tabla 3 ).
3. Resultados
3.1. Evaluación de la eficacia de limpieza del producto Wipe para la eliminación de material fecal simulado (Feclone™)
Se utilizó el método Antera 3D™ adaptado para evaluar la eficacia de limpieza de las toallitas de prueba en la eliminación de Feclone™ de los antebrazos de los voluntarios. Los resultados se analizaron mediante el parámetro de volumen del software Antera 3D™. El volumen se refiere al grosor o volumen total de cualquier residuo o contaminante en la superficie de la piel, y la reducción de volumen tras la limpieza indica una eliminación exitosa (véase la Figura 1 ). El porcentaje de eliminación se calculó mediante la siguiente fórmula:
𝑠𝑣0−𝑠𝑣1⁄𝑠𝑣0×100sv0−sv1∕sv0×100
donde SV0 = Volumen de piel (mm3) con prelimpieza con Feclone™.
SV1 = (Volumen de piel (mm3) después de la limpieza — volumen de piel (mm3) antes de la aplicación de Feclone™).
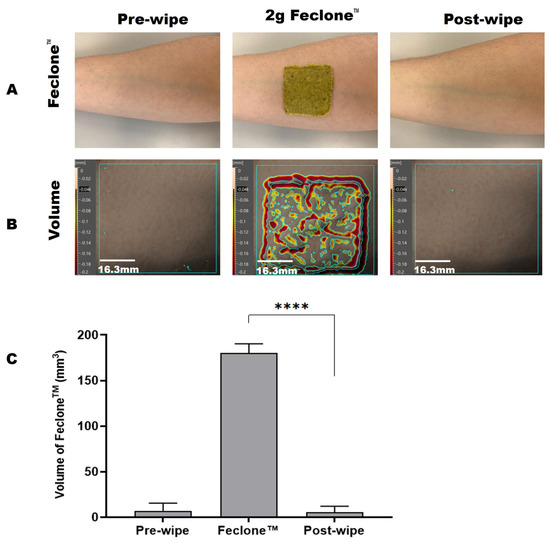
Figura 1. ( A ) Imágenes representativas que muestran la piel del antebrazo humano antes y después de aplicar y retirar Feclone™ con el producto de toallita de prueba; las imágenes se obtuvieron con la cámara de un teléfono. ( B ) Volumen de Feclone™ detectado en la superficie de la piel del antebrazo utilizando el método Antera 3D™ y limpiando con el producto de toallita. El área de aplicación para el análisis fue de 40 mm × 40 mm. La barra de escala vertical representa el volumen y la topografía de la piel, mientras que la barra de escala horizontal se refiere a la medición 2D de la región de piel definida. ( C ) Muestra los volúmenes de piel antes de la limpieza, Feclone™ y después de la limpieza observados con el método Antera 3DTM. Se observó que el producto de toallita reducía el aumento del volumen de la piel inducido por Feclone™ a los niveles previos a la aplicación. Un análisis de prueba t pareada del volumen de piel residual administrado con Feclone™ y después de la limpieza mostró una diferencia altamente significativa (**** p < 0,0001). El gráfico se representó como media y desviación estándar (DE) con GraphPad Prism 10 (GraphPad Software, 225 Franklin Street, Fl. 26, Boston, MA 02110, EE. UU.). Esto representa una eficiencia de limpieza promedio del 100,92 %.
3.2. Evaluación del producto de toallita en los poros de la piel humana
Se observó una reducción en los parámetros de los poros, como el recuento total de poros, el volumen de los poros y el área, después de limpiar la piel del antebrazo del voluntario con el producto de limpieza ( Figura 2 ).
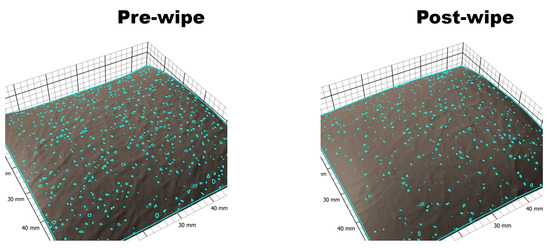
Figura 2. Una imagen representativa del software Antera 3DTM que muestra la reducción observada en los poros detectables de la piel (recuento, área total, volumen total) después de la limpieza con el producto de toallita.
3.3. Evaluación de la eficacia de limpieza del producto Wipe para eliminar E. coli
También se evaluó la eficacia del producto de toallitas para eliminar la contaminación bacteriana. Se calculó el número de UFC/ml para cada área y se determinaron los promedios. Estos hallazgos indican que el producto de toallitas eliminó eficazmente el 99,99 % de las células bacterianas y limpió eficazmente las áreas de piel contaminadas. Esto se validó mediante la recolección de las toallitas usadas para la cuantificación bacteriana después de la limpieza, así como mediante el frotis de la zona limpia para el cultivo en placas de TSA (véanse las Figuras 3 A, B).
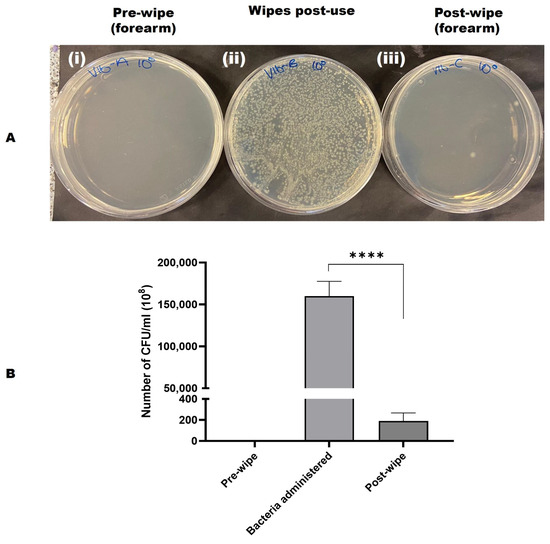
Figura 3. ( A ) Una imagen representativa que muestra la eficiencia de eliminación bacteriana de toallitas de prueba de piel humana contaminada. ( i ) Hisopo pre-limpieza en placa ( ii ) Toallita usada en placa ( iii ) Hisopo post-limpieza en placa. V = voluntario, A = Muestra pre-limpieza, B = Toallita post-uso, C = Muestra post-limpieza, 100 = muestra pura/sin diluir. ( B ) Gráfico de eficiencia de eliminación bacteriana del producto de toallita usando E. coli y conteo microbiológico. Se observó que las toallitas de prueba tuvieron una eliminación de bacterias del 99.99% de lo que se administró. El análisis de prueba t pareada de bacterias administradas y conteo post-limpieza mostró una diferencia altamente significativa (**** p < 0.0001). El gráfico fue trazado como media con DE (desviación estándar) usando GraphPad Prism 10. V = voluntario, A = Muestra pre-limpieza, B = Toallita post-uso, C = Muestra post-limpieza, 100 = muestra pura/sin diluir.
4. Discusión
Este estudio tuvo como objetivo diseñar y evaluar un método alternativo para llevar a cabo estudios de eficiencia de limpieza de productos de toallitas utilizando una cámara Antera 3D™, un dispositivo de imágenes dérmicas y análisis. Se utilizaron toallitas para bebés disponibles comercialmente (WaterWipes®) en este estudio y se probaron para su eficiencia de limpieza con materia fecal sintética (Feclone™) y E. coli contaminante de la superficie de la piel de los antebrazos de voluntarios. La cámara Antera 3D™, una herramienta de evaluación de productos cosméticos validada [ 11 ], se ha empleado en muchos estudios cosméticos como los que implican la cuantificación de arrugas, acné y pigmentación [ 11 , 18 , 19 ], y por lo tanto, se desarrolló una adaptación de la norma europea BS EN 1500:2013 [ 1 ] que incorpora la cámara Antera 3D™ para la evaluación cuantitativa y cualitativa de la eficiencia de limpieza de las toallitas y se probó utilizando el producto de toallitas. El análisis objetivo de la prueba FecloneTM utilizó el parámetro de volumen del software para proporcionar una evaluación en profundidad de la eficiencia de limpieza de las toallitas.
Los resultados de la evaluación visual y el análisis de la cámara Antera 3D™ demostraron que este método fue adecuado para evaluar la eliminación de Feclone™ de la piel humana mediante toallitas, que mostraron una eficiencia de limpieza de Feclone™ del 100,92 %. Nuestra hipótesis es que el valor de eliminación >100 % podría deberse a la sensibilidad del método de la cámara Antera 3D™ para detectar la eliminación con toallitas tanto del Feclone™ aplicado como de cualquier residuo cutáneo preexistente. Lee et al. [ 8 ] informaron sobre un enfoque de imágenes similar para determinar la eficiencia de limpieza con toallitas, que consiste en una computadora con un escáner y un software de análisis de imágenes; sin embargo, este estudio se realizó utilizando un contaminante extendido sobre una placa de vidrio y no piel humana. Por lo tanto, las técnicas de imágenes proporcionan una alternativa al método gravimétrico tradicional utilizado para evaluar la eficiencia de limpieza de las toallitas, que se ha informado que es propenso a errores experimentales.
El método gravimétrico generalmente implica registrar el peso de la toallita antes y después de limpiarla para determinar su eficiencia de limpieza. Esta técnica se centra en el análisis de la toallita, no de la superficie que se limpia. Se ha reportado que el método es propenso a errores derivados del proceso, como la manipulación de las toallitas durante el pesaje, que podría provocar la transferencia de humedad de la toallita a los guantes del evaluador y la inevitable evaporación de la humedad de las toallitas de prueba. Todo esto podría afectar los resultados obtenidos y debe considerarse como variables experimentales. Sin embargo, con el método de la cámara Antera 3D™, un enfoque óptico, la evaporación y la manipulación de la humedad de la toallita son menos preocupantes, ya que la eficiencia de limpieza se deduce directamente de la superficie de la piel y no de la diferencia en el peso de las toallitas. Esto hace que este método sea potencialmente útil para abordar errores comunes en el análisis gravimétrico. Otras ventajas asociadas con los métodos propuestos de la cámara Antera 3D™ incluyen su capacidad de imágenes 3D de la piel, facilidad de uso, precisión, reproducibilidad y su lectura múltiple para parámetros de la piel como tamaño de poro, imperfecciones, arrugas y rugosidad. Sin embargo, se observan algunas limitaciones con los modelos propuestos, que incluyen incertidumbre sobre su aplicabilidad en otras áreas de caracterización de la eficiencia de las toallitas húmedas, como el análisis de la tasa de secado de las toallitas (tasa de evaporación de la humedad de la toallita cuando se expone a la atmósfera a lo largo del tiempo), el análisis de la absorción de la toallita (capacidad de la toallita para absorber loción) y los estudios de transferencia de loción (liberación de loción de la toallita a la piel) [ 1 , 8 , 20 ]. Dado que el método propuesto utiliza un dispositivo específico, se requieren la cámara Antera 3D™ y el software asociado para ejecutar o reproducir el método, una posible limitación de la aplicación generalizada. El modelo es una técnica óptica con variables como distancia fija, grado de resolución (0,1 mm) y banda espectral (siete) obtenibles con la cámara Antera 3D™, lo que hace que la topografía de la piel reconstruida sea una estimación [ 21 ]. La sensibilidad de la técnica propuesta le permite detectar lo que está presente en la piel (cabello, poros, sebo, cicatrices, pecas, etc.); sin embargo, no se espera que esto influya ni cause artefactos en los datos generados, ya que el protocolo establece que primero se tomen lecturas basales de la piel.
Curiosamente, se observó que limpiar la piel con el producto de toallita en cuestión tuvo un impacto en la reducción del recuento medio total de poros, el volumen y el área, y esto es de notable importancia, ya que varios estudios han demostrado una relación entre un recuento de poros más bajo y una piel más sana [ 14 , 22 , 23 ]. Esto probablemente se atribuya a la combinación de la formulación y la composición de la toallita, por la cual una formulación de baja tensión superficial se extiende y humedece los poros de la piel lo suficiente como para permitir que la toallita limpie eficazmente los poros de sebo, sudor y otros restos celulares. La reducción en el recuento medio de poros y el tamaño también puede ser ayudada por la temperatura más fría de las propias toallitas. La temperatura de las toallitas parece más fría que la temperatura de la piel; por lo tanto, esta podría ser la razón por la que los poros se cierran temporalmente. Algunos estudios han informado que enfriar la piel conduce a una reducción en el tamaño y el recuento de poros a través de la vasoconstricción cutánea y el estiramiento de la piel [ 24 , 25 , 26 ]. Además, se informa que el extracto de semilla de pomelo (GSE), un ingrediente acondicionador de la piel y un ingrediente en el producto de toallita utilizado, tiene propiedades antimicrobianas [ 27 , 28 , 29 , 30 ]. También se informa que posee actividad antioxidante y ayuda a aliviar la congestión de la piel purificando, limpiando y despejando los poros obstruidos de la piel para una luminosidad de la piel suave y luminosa, así como apretando los poros de la piel debido a su capacidad matificante [ 31 , 32 ]. Se propone que estas toallitas, WaterWipes® (WaterWipes UC, Drogheda, Irlanda), podrían encontrar uso como una forma menos invasiva de limpiar los poros y minimizar su apariencia, dado que, cuando se toman en conjunto, el cambio en el área, el volumen y el recuento de los poros después de la limpieza podría ser una combinación de todas las razones anteriores; Sin embargo, este es un tema aparte, y se necesita más investigación para validar estos hallazgos y determinar el mecanismo de acción exacto, ya que en este estudio no se tuvieron en cuenta las temperaturas de las toallitas ni de la piel de los voluntarios. No obstante, la cámara Antera 3D™ (Miravex Ltd., Dublín, Irlanda) con capacidad de visualización y medición de poros proporcionó una mejor comprensión del efecto del producto en la piel.
5. Conclusiones
En conclusión, los hallazgos de este estudio demuestran que el método de la cámara Antera 3D™ puede ser una técnica alternativa eficaz para evaluar la eficacia de las toallitas limpiadoras. Entre sus ventajas se incluyen su facilidad de uso, la reproducibilidad de los datos, la luz controlada en el área interna de la imagen y su carácter portátil, de alta resolución y con lectura multiparamétrica. Sin embargo, dado que no se realizó ninguna comparación con otros métodos de evaluación de la eficacia de la limpieza (como la técnica gravimétrica), esta técnica propuesta pretende servir como una posible alternativa a los métodos existentes. Se observó que las toallitas utilizadas en este estudio presentan una buena eficacia de limpieza en cuanto a la eliminación sustancial de Feclone™ y E. coli de la piel humana. Investigaciones futuras podrían explorar el rendimiento de las toallitas en diferentes tipos de piel y zonas corporales, así como en diversas condiciones ambientales, para ampliar su aplicabilidad y la comprensión de la eficacia del método desarrollado. En resumen, este estudio aporta información valiosa sobre la eficacia del método de la cámara Antera 3D™ para medir la eficacia de la limpieza de las toallitas limpiadoras.
Contribuciones del autor
Conceptualización, TY, NB, JS y EG; metodología, AAAA, AM; KH y NB; Investigación y análisis de datos, AM, KH y WS; redacción: preparación del borrador original, WS; redacción: revisión y edición, WS, NB, JS, EG y TY; recursos, EG, JS y TY; supervisión, NB y TY; administración y financiación del proyecto, TY, EG y JS Todos los autores han leído y aceptado la versión publicada del manuscrito.
Fondos
Esta investigación recibió financiación de WaterWipes UC.
Declaración de la Junta de Revisión Institucional
Este ensayo con voluntarios humanos se llevó a cabo de conformidad con la Declaración de Helsinki y fue aprobado por el Comité de Ética de la Investigación Humana de la Universidad Tecnológica de Munster (referencia MTU-HREC-FER-24-004). La gobernanza del Comité de Ética de la Investigación Humana de la Universidad Tecnológica de Munster se describe en la Política de Ética de la Investigación Humana de la Universidad [ 33 ] y se alinea con la Declaración de Política Nacional para Garantizar la Integridad de la Investigación en Irlanda (Foro Nacional de Integridad de la Investigación (2019) [ 34 ]. Toda actividad de investigación que involucre a seres humanos como participantes debe someterse a una revisión ética formal antes de su inicio.
Declaración de consentimiento informado
Todos los voluntarios dieron su consentimiento informado por escrito antes de participar en este estudio.
Declaración de disponibilidad de datos
Todos los datos se pueden encontrar en este artículo.
Expresiones de gratitud
Se agradece a todos los voluntarios en ambos estudios por su papel en la recopilación de datos.
Conflictos de intereses
Las autoras Jill Sommerville y Emer Gilligan trabajaron para la empresa WaterWipes UC. El resto de los autores declaran que la investigación se realizó sin ninguna relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Referencias
- Cheriaa, R.; Boubaker, J. Evaluación de la calidad de toallitas húmedas para bebés. J. Ind. Text. 2022 , 51, 2124S–2147S. [ Google Académico ] [ CrossRef ]
- Visscher, M.; Odio, M.; Taylor, T.; White, T.; Sargent, S.; Sluder, L.; Smith, L.; Flower, T.; Mason, B.; Rider, M.; et al. Cuidado de la piel en pacientes de la UCIN: Efectos de las toallitas frente a los paños y el agua en la integridad del estrato córneo. Neonatología 2009 , 96, 226–234. [ Google Académico ] [ CrossRef ] [ PubMed ]
- García Bartels, N.; Massoudy, L.; Scheufele, R.; Dietz, E.; Proquitté, H.; Wauer, R.; Bertin, C.; Serrano, J.; Blume-Peytavi, U. Régimen estandarizado de cuidado del pañal: Un estudio piloto prospectivo y aleatorizado sobre la función de la barrera cutánea y la IL-1α epidérmica en recién nacidos. Pediatr. Dermatol. 2012 , 29, 270–276. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Rodríguez, KJ; Cunningham, C.; Foxenberg, R.; Hoffman, D.; Vongsa, R. La ciencia detrás de las toallitas húmedas para la piel del bebé: Revisión de ingredientes, seguridad y eficacia. Pediatr. Dermatol. 2020 , 37, 447–454. [ Google Académico ] [ CrossRef ]
- Odio, M.; Streicher-Scott, J.; Hansen, RC Toallitas húmedas desechables para bebés: Eficacia y suavidad para la piel. Dermatol. Nurs. 2001 , 13, 107–112, 117–118, 121. [ Google Scholar ]
- Ehretsmann, C.; Schaefer, P.; Adam, R. Tolerancia cutánea a las toallitas húmedas en bebés con dermatitis atópica y comparación de la suavidad de las toallitas húmedas y el agua en la piel de los bebés. J. Eur. Acad. Dermatol. Venereol. 2001 , 15, 16–21. [ Google Académico ] [ CrossRef ]
- Blume-Peytavi, U.; Lavender, T.; Jenerowicz, D.; Ryumina, I.; Stalder, J.; Torrelo, A.; Cork, MJ. Recomendaciones de una mesa redonda europea sobre buenas prácticas para el cuidado de la piel infantil saludable. Pediatr. Dermatol. 2016 , 33, 311–321. [ Google Académico ] [ CrossRef ]
- Lee, J.; Kim, S.; Oh, KW. Análisis de imágenes: Una técnica novedosa para determinar la eficiencia de los paños de limpieza. Fibers Polym. Fiber Polym. 2006 , 7, 73–78. [ Google Académico ] [ CrossRef ]
- Kandil, SM; Soliman, II; Diab, HM; Bedair, NI; Mahrous, MH; Abdou, EM. Portadores vesiculares de fosfato de ascorbilo y magnesio para administración tópica; preparación, evaluación in vitro y ex vivo, optimización factorial y evaluación clínica en pacientes con melasma. Drug Deliv. 2022 , 29, 534–547. [ Google Académico ] [ CrossRef ]
- Prendergast, PM, Imagenología de la piel en medicina estética. En Medicina estética: Arte y técnicas; Prendergast, PM, Shiffman, MA, Eds.; Springer: Berlín/Heidelberg, Alemania, 2012; págs. 59-68. ISBN 978-3-642-20113-4. [ Google Scholar ]
- Messaraa, C.; Metois, A.; Walsh, M.; Hurley, S.; Doyle, L.; Mansfield, A.; O'Connor, C.; Mavon, A. Medición de arrugas y rugosidad con Antera 3D y su aplicación para la evaluación de productos cosméticos. Skin Res. Technol. 2018 , 24, 359–366. [ Google Académico ] [ CrossRef ]
- Araco, A.; Francesco, A. Estudio clínico prospectivo y aleatorizado de una nueva formulación tópica para la reducción de arrugas faciales y la regeneración dérmica. J. Cosmet. Dermatol. 2021 , 20, 2832–2840. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Anqi, S.; Xiukun, S.; Ai'e, X. Evaluación cuantitativa de piel sensible mediante ANTERA 3D® en combinación con GPSkin Barrier®. Skin Res. Technol. 2022 , 28, 840–845. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Parvar, SY; Amani, M.; Shafiei, M.; Rastaghi, F.; Hosseini, SA; Ahramiyanpour, N. Eficacia y efectos adversos de las opciones de tratamiento para los poros faciales: Un artículo de revisión. J. Cosmet. Dermatol. 2023 , 22, 763–775. [ Google Académico ] [ CrossRef ] [ PubMed ]
- WaterWipe. Nuestra historia sobre las toallitas húmedas para bebés | WaterWipes UK. WaterWipes. Disponible en línea: https://www.waterwipes.com/uk/en/our-story (consultado el 12 de julio de 2024).
- Marsh, RG; Miller, KH; Dannenberg, A. Método para evaluar la adhesión de suciedad o exudados a la piel. US20100228107A1, 9 de septiembre de 2010. Disponible en línea: https://patents.google.com/patent/US20100228107A1/en (consultado el 3 de julio de 2024).
- Jubinville, E.; Girard, M.; Trudel-Ferland, M.; Fliss, I.; Jean, J. Inactivación de norovirus murinos suspendidos en materia orgánica que simula condiciones reales de contaminación viral. Food Environ. Virol. 2021 , 13, 544–552. [ Google Académico ] [ CrossRef ]
- Araco, A.; Araco, F. Estudio preliminar prospectivo y aleatorizado de polinucleótidos altamente purificados frente a placebo en el tratamiento de cicatrices de acné moderadas a graves. Aesthet. Surg. J. 2021 , 41, NP866–NP874. [ Google Académico ] [ CrossRef ]
- Niemeyer-van der Kolk, T.; Buters, TP.; Krouwels, L.; Boltjes, J.; de Kam, ML.; van der Wall, H.; van Alewijk, DCJG; van den Munckhof, EHA; Becker, MJ; Feiss, G.; et al. El péptido antimicrobiano tópico omiganan recupera la disbiosis cutánea, pero no mejora los síntomas clínicos en pacientes con dermatitis atópica leve a moderada en un ensayo controlado aleatorizado de fase 2. J. Am. Acad. Dermatol. 2022 , 86, 854–862. [ Google Académico ] [ CrossRef ]
- Hossain, MM; Jones, JM; Dey, S.; Carr, GJ; Visscher, MO. Cuantificación de la transferencia de loción de toallitas húmedas a la piel de prematuros y neonatos. Food Chem. Toxicol. 2015 , 84, 106–114. [ Google Académico ] [ CrossRef ]
- Gitlina, Y.; Guarnera, GC; Dhillon, DS; Hansen, J.; Lattas, A.; Pai, D.; Ghosh, A. Medición práctica y reconstrucción de la reflectancia espectral de la piel. Comput. Graph. Forum 2020 , 39, 75–89. [ Google Académico ] [ CrossRef ]
- Messaraa, C.; Metois, A.; Walsh, M.; Flynn, J.; Doyle, L.; Robertson, N.; Mansfield, A.; O'Connor, C.; Mavon, A. Capacidades 3D de Antera para mediciones de poros. Skin Res. Technol. 2018 , 24, 606–613. [ Google Académico ] [ CrossRef ]
- Vachiramon, V.; Namasondhi, A.; Anuntrangsee, T.; Kositkuljorn, C.; Jurairattanaporn, N. Estudio de la combinación de ultrasonido microfocalizado y relleno dérmico de ácido hialurónico para el tratamiento de poros faciales dilatados en asiáticos. J. Cosmet. Dermatol. 2021 , 20, 3467–3474. [ Google Académico ] [ CrossRef ]
- Shahzad, Y.; Louw, R.; Gerber, M.; du Plessis, J. Rompiendo la barrera cutánea mediante modulaciones de temperatura. J. Control. Versión 2015 , 202, 1–13. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Johnson, JM; Kellogg, DL. Control térmico local de la circulación cutánea humana. J. Appl. Physiol. 2010 , 109, 1229–1238. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Charkoudian, N. Flujo sanguíneo cutáneo en la termorregulación humana adulta: Cómo funciona, cuándo no funciona y por qué. Mayo Clin. Proc. 2003 , 78, 603–612. [ Google Académico ] [ CrossRef ] [ PubMed ]
- Park, H.-K.; Kim, S.-B. Actividad antimicrobiana del extracto de semilla de pomelo. Korean J. Food Nutr. 2006 , 19, 526–531. [ Google Académico ]
- Sung-Hwan, CHO; Il-Won, SEO; Jong-Duck, C.; In-Saeng, JOO. Actividad antimicrobiana y antioxidante del pomelo y el extracto de semilla en productos pesqueros. Korean J. Fish. Aquat. Sci. 1990 , 23, 289–296. [ Google Académico ]
- Jong-Duck, C.; Il-Won, SEO; Sung-Hwan, CHO. Estudios sobre la actividad antimicrobiana del extracto de semilla de pomelo. Korean J. Fish. Aquat. Sci. 1990 , 23, 297–302. [ Google Académico ]
- Saaty, AH. Actividad antibacteriana y antiviral de los extractos de semilla de pomelo: Impacto del coronavirus 2 en el síndrome respiratorio agudo severo. Arch. Pharm. Pract. 2022 , 13, 68–73. [ Google Académico ] [ CrossRef ]
- Khaiat, A.; Saliou, C. Extractos botánicos. En Cosmecéuticos y cosméticos activos, 3.ª ed.; CRC Press: Boca Ratón, Florida, EE. UU., 2015. [ Google Scholar ]
- Yarovaya, L.; Waranuch, N.; Wisuitiprot, W.; Khunkitti, W. Estudio clínico de los cambios en la piel asiática tras la aplicación de un protector solar con extracto de semilla de uva. J. Cosmet. Dermatol. 2022 , 21, 4523–4535. [ Google Académico ] [ CrossRef ]
- MTU. Política de Ética de la Investigación en Seres Humanos de la MTU. Disponible en línea: https://www.mtu.ie/media/mtu-website/governance/policies-and-publications/academic-council-poli-cies-and-regulations/research-innovation-and-postgraduate-study/Human_Research_Ethics_Policy_AC_app_030622.pdf (consultado el 16 de julio de 2024).
- Wood, K. Declaración de Política Nacional para Garantizar la Integridad de la Investigación en Irlanda. Disponible en línea: https://www.iua.ie/publications/national-policy-statement-on-ensuring-research-integrity-in-ireland/ (consultado el 5 de septiembre de 2024).
Aviso legal/Nota del editor: Las declaraciones, opiniones y datos contenidos en todas las publicaciones son exclusivamente de los autores y colaboradores, y no de MDPI ni de sus editores. MDPI y sus editores no se responsabilizan de ningún daño a personas o bienes que resulte de las ideas, métodos, instrucciones o productos mencionados en el contenido.
© 2024 de los autores. Licenciatario: MDPI, Basilea, Suiza. Este artículo es de acceso abierto y se distribuye bajo los términos y condiciones de la licencia Creative Commons Atribución (CC BY) ( https://creativecommons.org/licenses/by/4.0/ ).
More on the Skincare Hub
View allPiel seca vs piel deshidratada: ¿cuál es la diferencia y cómo cuidarla?
¿Cuál es la diferencia y cómo cuidarlo?

Dermatitis del pañal
La dermatitis del pañal es un problema común que experimentan muchos bebés, pero como padres primerizos, a menudo puede ser bastante angustiante ver a tu pequeño con molestias o irritado. Sin embargo, hay varias medidas que puedes tomar para ayudar a prevenir y controlar la dermatitis del pañal. Aquí respondo algunas de las preguntas más frecuentes sobre la dermatitis del pañal, que espero te ayuden a cuidar de tu pequeño. – Dra. Alexis Granite